Welcome to the official website of Sinos (Suzhou) Bioengineering Co., Ltd!
COVID 19 Antigen-Prüfkit (Verfahren mit kolloidalem Gold)
date:2021-09-18 23:46



COVID 19 Antigen Test Kit (Colloidal Gold Method)
Nasale / Nasopharyngeale und oropharyngeale Probe
Gebrauchsanweisung
Gebrauchsanweisung
Für die professionelle Verwendung
[Produktname]
COVID 19 Antigen Test Kit (Colloidal Gold Method)
[Verpackungsspezifikation]
Prüfkassette (Einzelprüfung-Verpackung):
1 Prüfung/Kassette; 5 Prüfungen/Kassette; 10 Prüfungen/Kassette; 15 Prüfungen/Kassette.
1 Prüfung/Kassette; 5 Prüfungen/Kassette; 10 Prüfungen/Kassette; 15 Prüfungen/Kassette.
[Verwendungszweck]
Dieses Reagenz wird für den qualitativen In-vitro-Test des COVID 19 Antigen N-Proteins in humanen nasalen /Nasopharyngealen und oropharyngealen Proben verwendet. Synthetisches Spinous-Protein und genetische Varianten von UK können nicht nachgewiesen werden
Er wird nur als zusätzlicher Testindikator bei Verdachtsfällen mit negativem Ergebnis des COVID 19-Tests oder in Kombination mit dem 2019-nCov IgG / IgM-Antikörper-Testkit zur Hilfsdiagnose bei Verdachtsfällen verwendet. Er kann nicht als Grundlage für die Bestätigung oder Diagnose einer durch eine COVID 19-Infektion verursachten Lungenentzündung verwendet werden. Ein positives Prüfergebnis erfordert eine weitere Bestätigung, und ein negatives Prüfergebnis kann die Möglichkeit einer Infektion nicht ausschließen.
Das Novel Coronavirus 2019, auch bekannt als COVID 19, ist eine akute Infektionskrankheit der Atemwege. Menschen sind generell empfänglich. Derzeit sind die mit dem COVID 19 infizierten Patienten die Hauptinfektionsquelle; asymptomatische infizierte Personen können ebenfalls eine Infektionsquelle sein. Basierend auf der aktuellen epidemiologischen Untersuchung beträgt die Inkubationszeit 1 bis 14 Tage, meistens 3 bis 7 Tage. Zu den Hauptmanifestationen gehören Fieber, Müdigkeit und trockener Husten. Nasenverstopfung, laufende Nase, Halsschmerzen, Myalgie und Durchfall werden in wenigen Fällen beobachtet.
Er wird nur als zusätzlicher Testindikator bei Verdachtsfällen mit negativem Ergebnis des COVID 19-Tests oder in Kombination mit dem 2019-nCov IgG / IgM-Antikörper-Testkit zur Hilfsdiagnose bei Verdachtsfällen verwendet. Er kann nicht als Grundlage für die Bestätigung oder Diagnose einer durch eine COVID 19-Infektion verursachten Lungenentzündung verwendet werden. Ein positives Prüfergebnis erfordert eine weitere Bestätigung, und ein negatives Prüfergebnis kann die Möglichkeit einer Infektion nicht ausschließen.
Das Novel Coronavirus 2019, auch bekannt als COVID 19, ist eine akute Infektionskrankheit der Atemwege. Menschen sind generell empfänglich. Derzeit sind die mit dem COVID 19 infizierten Patienten die Hauptinfektionsquelle; asymptomatische infizierte Personen können ebenfalls eine Infektionsquelle sein. Basierend auf der aktuellen epidemiologischen Untersuchung beträgt die Inkubationszeit 1 bis 14 Tage, meistens 3 bis 7 Tage. Zu den Hauptmanifestationen gehören Fieber, Müdigkeit und trockener Husten. Nasenverstopfung, laufende Nase, Halsschmerzen, Myalgie und Durchfall werden in wenigen Fällen beobachtet.
[Prüfprinzip]
von COVID 19-Antigenproben verwendet.
Bei der Prüfung werden 3 Tropfen der vorbehandelten Probe (ca. 90 ul) in die Probenöffnung(en) der Prüfkarte gegeben. Wenn das COVID 19-Antigen in der Probe enthalten ist, können COVID 19-Antigene in der Probe kolloidale Goldkomplexe mit kolloidalem Gold markierten Antikörpern bilden. Der Komplex wird zusammen mit dem Prüfstreifen vorwärts bewegt und an der Prüflinienstelle (T) der Nitrocellulosemembran eingefangen. Der überschüssige, nicht konjugierte, mit kolloidalem Gold markierte Antikörper bewegt sich weiter vorwärts zur Position der Qualitätskontrolllinie und wird von dem Festphasen-Antikörper der Qualitätskontrolllinie eingefangen. Auf diese Weise bildet sich an der Position der Prüflinie (T) und der Position der Qualitätskontrolllinie (C) eine mit bloßem Auge sichtbare purpurrote Bande, die ein positives Ergebnis anzeigt. Enthält die Probe kein COVID 19-Antigen oder ist ihr Gehalt niedriger als die Nachweisgrenze, zeigt sie an der Prüflinienposition (T) keine Farbe und an der Qualitätskontrolllinienposition (C) wird nur eine purpurrote Bande angezeigt, was auf ein negatives Ergebnis hindeutet. Wenn an der Qualitätskontrolllinie (C) keine purpurrote Bande zu sehen ist, wird festgestellt, dass das Ergebnis ungültig ist, unabhängig davon, ob an der Position (T) der Prüflinie eine purpurrote Bande zu sehen ist, und es muss erneut bestimmt werden.
[Komponenten]
| 1. Prüfkassette | 2. Tupfer |
| 3. Extraktionsröhrchen | 4. Pufferröhrchen (600 ul/Flasche) |
| 5. Gebrauchsanweisung |
[Lagerbedingungen und Haltbarkeit]
Die Originalverpackung sollte an einem dunklen und trockenen Ort bei 2 °C~30 °C gelagert und nicht eingefroren werden. Die Haltbarkeit des Produkts beträgt 24 Monate. Das Reagenz sollte so schnell wie möglich innerhalb von 1 Stunde nach Öffnen des Alufolienbeutels verwendet werden.Herstellungsdatum: siehe Produktetikett. Verfallsdatum: siehe Produktetikett.
[Probenentnahme und -verarbeitung]
Bitte verwenden Sie für die Probennahme den in diesem Produkt enthaltenen Tupfer. Drehen Sie vor der Entnahme von nasalem/nasopharyngealem/oropharyngealem Sekret das im Testkit enthaltene Pufferröhrchen, geben Sie den Puffertropfen in das Entnahmeröhrchen und beginnen Sie dann mit der Probenahme.
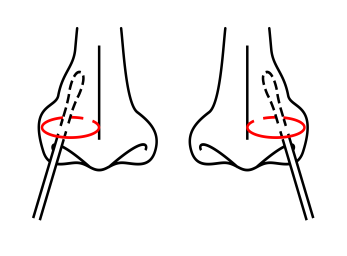
Hinweis: Führen Sie beim Sammeln des Nasensekrets den Tupfer vorsichtig in das 2,5-3 cm entfernte Nasenloch ein und drehen Sie den Tupfer mehrmals kreisförmig an der Innenwand
Hinweis: Führen Sie beim Sammeln des Nasensekrets den Tupfer vorsichtig in das 2,5-3 cm entfernte Nasenloch ein und drehen Sie den Tupfer mehrmals kreisförmig an der Innenwand
des Nasenlochs, um sicherzustellen, dass so viele Zellen und Schleim wie möglich gesammelt werden. Wiederholen Sie den gleichen Vorgang mit dem gleichen Tupfer im anderen Nasenloch.
Beim Sammeln des nasopharyngealen Sekrets führen Sie den Tupfer vorsichtig in den am meisten sezernierenden Teil des Nasenlochs ein und schieben ihn in Richtung Nasenhöhle bis zum Nasenmuschelknochen. Drehen Sie den Tupfer mehrmals kreisförmig an der Innenwand des Nasenlochs, um sicherzustellen, dass so viele Zellen und Schleim wie möglich gesammelt werden.
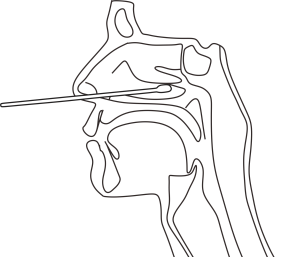
Bei der Entnahme des oropharyngealen Tupfers führen Sie den Tupfer in den Teil des Rachens ein, in dem sich am meisten Speichel befindet, schütteln Sie den Tupfer vorsichtig an der Innenwand des Rachens und nehmen Sie den Tupfer heraus, nachdem genügend Proben eingetaucht wurden,Nach der Entnahme.
Legen Sie den Tupfer mit der Probe in den Puffer des Extraktionsröhrchens, drücken Sie die Probe eine Minute lang mit den Fingern vollständig zusammen, so dass die Probe vollständig im Verdünnungsmittel gelöst ist. Nachdem der Tupfer so weit wie möglich herausgezogen wurde, wird die Flüssigkeit im Plastikröhrchen als zu prüfende Probe entnommen, und der obere Deckel des Plastikröhrchens wird geschlossen, und die Prüfung wird sofort durchgeführt. Wenn es für eine lange Zeit nicht benutzt wird, muss es auf 2 ℃~8 ℃ gekühlt werden, die Lagerzeit der Proben sollte 3 Tage nicht überschreiten.
| Nasale Probenahme | Nasopharyngeale Probennahme | Oropharyngeale Probennahme |
 |
 |
 |
[Testverfahren]
1. Vor der Prüfung sollten die Prüfkassette und die Probe auf Raumtemperatur gebracht werden.2. Öffnen Sie die Aluminiumfolienverpackung, nehmen Sie die Prüfkassette heraus und legen Sie sie auf den horizontalen Tisch.
3. Drehen Sie das Kunststoffröhrchen mit der behandelten Probe um und geben Sie 3 Tropfen (ca. 90 ul) in die Probenöffnung(en) der Prüfkassette. Warten Sie 15 Minuten und beobachten Sie die Ergebnisse. Bitte beachten Sie, dass das Ergebnis
nach 30 Minuten ungültig ist.
4. Das Fenster “C” ist die Kontrolllinie, “T” ist die Prüflinie.
[Interpretation der Ergebnisse]
Positives Prüfergebnis: Zwei purpurrote C-Linien und T-Linien erscheinen gleichzeitig im Prüfbereich. Die Ergebnisse waren positiv. Dies zeigt an, dass sich COVID 19 in der Probe befindet.Negative Prüfergebnisse: Die Kontrolllinie (C) ist die einzige sichtbare Linie im Prüfbereich. Es wurde kein COVID 19-Antigen nachgewiesen. Das Ergebnis schließt eine Infektion nicht aus. Bei fortbestehenden Symptomen sollten dem Patienten innerhalb von 3-5 Tagen neue Proben entnommen und erneut geprüft werden.
Ungültige Prüfergebnisse: Wenn die Kontrolllinie (C) im Prüfbereich nicht erscheint, ist das Prüfergebnis ungültig, unabhängig davon, ob andere Linien im Prüfbereich sichtbar sind. Wiederholen Sie die Prüfung mit einer neuen Reagenzienkassette.
[Produktleistungsindex]
1. Überprüfung der Referenzmaterialien des Unternehmens:
1.1 Positive Koinzidenzrate: COVID 19 Antigen-Referenzmaterial P1 ~ P8 sollte positiv getestet werden, mit einer Koinzidenzrate von 8/8.
1.2 Negative Koinzidenzrate: COVID 19 Referenzmaterial N1 ~ N20 wurde zum Nachweis verwendet. Sie sollten alle negativ sein, mit einer Koinzidenzrate von 20/20.
1.1 Positive Koinzidenzrate: COVID 19 Antigen-Referenzmaterial P1 ~ P8 sollte positiv getestet werden, mit einer Koinzidenzrate von 8/8.
1.2 Negative Koinzidenzrate: COVID 19 Referenzmaterial N1 ~ N20 wurde zum Nachweis verwendet. Sie sollten alle negativ sein, mit einer Koinzidenzrate von 20/20.
1.3 Nachweisgrenze: Für den Nachweis wurde das COVID 19 Referenzmaterial S1~S6 verwendet., S1 bis S4 sollten positiv sein, S5 und S6 sind nicht erforderlich.
1.4 Reproduzierbarkeit: Die COVID 19 Antigen-Referenzmaterialien R1 und R2 wurden für 10 Tests verwendet. Die Ergebnisse sollten positiv sein und die Chromatizität war einheitlich.
2. HAKEN-Effekt: Das COVID 19 Antigen positive Referenzmaterial mit der höchsten Konzentration wurde im Kit ohne HAKEN-Effekt nachgewiesen.
3. Es gab keine Kreuzreaktion und Interferenz mit den unten aufgeführten potenziell kreuzreagierenden Mikroorganismen.
| Substanz | Stamm | Konzentration | Ergebnisse |
| Humanes Coronavirus | MERS | 5ug/ml | keine Kreuzreaktion |
| OC43 | 1:20 | keine Kreuzreaktion | |
| 229E | 1:20 | keine Kreuzreaktion | |
| HKU1 | 1:20 | keine Kreuzreaktion | |
|
Influenza-B-Virus |
Yamagata | 1:20 | keine Interferenz |
| victoria | 1:20 | keine Interferenz | |
| Influenza-A-Virus | H5N1 1:40 | 1:40 | keine Interferenz |
| H7N9 1:40 | 1:40 | keine Interferenz | |
| H3N2 1:40 | 1:40 | keine Interferenz | |
| HIN1 5 ug/ml | 5ug/ml | keine Interferenz | |
| B-V 5 ug/ml | / | 5ug/ml | keine Interferenz |
| Masern | / | 1:40 | keine Interferenz |
| Rotavirus | / | 1:40 | keine Interferenz |
| CMV | / | 1:40 | keine Interferenz |
| Chlamydia |
TWAR-Stamm TW-183 |
1:40 | keine Interferenz |
| RSV | / | 50ug/ml | keine Interferenz |
| Mumps-Virus | / | 50ug/ml | keine Interferenz |
| Adeno-Virus | Typ 1 | 10ug/ml | keine Interferenz |
| Typ 2 | 10ug/ml | keine Interferenz | |
| Typ 3 | 10ug/ml | keine Interferenz | |
| Typ 4 | 10ug/ml | keine Interferenz | |
| Typ 5 | 10ug/ml | keine Interferenz | |
| Typ 7 | 10ug/ml | keine Interferenz | |
| Typ 55 | 10ug/ml | keine Interferenz | |
| Parainfluenza | Typ 1 | 5ug/ml | keine Interferenz |
| Typ 2 | 5ug/ml | keine Interferenz | |
| Typ 3 | 5ug/ml | keine Interferenz | |
| Typ 4A | 5ug/ml | keine Interferenz | |
| VZ | / | 30ug/ml | keine Interferenz |
4. Klinische Leistung
4.1 Nasale proben
Die klinische Leistung des COVID 19-Antigen-Testkits (kolloidales Goldverfahren) wurde durch Testen von 122 positiven und 123 negativen Proben auf das COVID 19-Antigen N-Protein bestimmt und ergab eine Sensitivität von 95,90% [92,38%, 99,42%]; Spezifität von 99,19% [97,60%, 100,77%]; Gesamtkoinzidenzrate 97,55% [85,18%, 109,92%];
| Nasale proben | PCR-Prüfergebnisse | Gesamt | ||
| Positiv | Negativ | |||
| COVID 19 Antigen-Prüfkit (kolloidales Goldverfahren) N-Protein-Ergebnisse | Positiv | 118 | 1 | 119 |
| Negativ | 5 | 122 | 128 | |
| Gesamt | 123 | 123 | 246 | |
| Sensitivität | Spezifität | Gesamt-Koinzidenzrate | ||
|
95,94%; [92,44%,99,42%]; |
99,19% [97,60%,100,77%]; |
97,56%; [85,18%,109,90%]; |
||
Die klinische Leistung des COVID 19-Antigen-Testkits (Methode mit kolloidalem Gold) wurde durch Testen von 122 positiven und 123 negativen Proben auf das COVID 19-Antigen N-Protein mit einer Sensitivität von 98,36% [96,11%,100,61%]; Spezifität von 99,19% [97,60%,100,77%]; Gesamtkoinzidenzrate 98,78% [86,33%,111,22%] bestimmt;
| Nasopharyngeale/oropharyngeale Proben | PCR-Prüfergebnisse | Gesamt | ||
| Positiv | Negativ | |||
| COVID 19 Antigen-Prüfkit (kolloidales Goldverfahren) N-Protein-Ergebnisse | Positiv | 120 | 1 | 121 |
| Negativ | 2 | 122 | 124 | |
| Gesamt | 122 | 123 | 245 | |
| Sensitivität | Spezifität | Gesamt-Koinzidenzrate | ||
|
98,36%; [96,11%,100,61%]; |
99,19% [97,60%,100,77%]; |
98,78%; [86,33%,111,22%]; |
||
[Vorsichtsmaßnahmen]
1. Dieses Produkt wird nur für das vorläufige Screening der In-vitro-Diagnose verwendet. Bitte verwenden Sie es nicht als Bestätigungsreagenz. Die positiven Ergebnisse müssen in Kombination mit klinischen Symptomen und anderen Prüfungen bestätigt werden.2. Aufgrund verfahrenstechnischer oder antigener Spezifität kann die Prüfung der gleichen Probe mit Reagenzien verschiedener Hersteller zu unterschiedlichen Prüfergebnissen führen. Daher sollten die Ergebnisse, die durch die Prüfung mit verschiedenen Reagenzien erhalten wurden, nicht direkt miteinander verglichen werden, um eine falsche medizinische Interpretation zu vermeiden. Es wird empfohlen, dass das Labor die Eigenschaften der verwendeten Reagenzien im Prüfbericht für den Kliniker angibt.
3. Die Reagenzien sollten versiegelt und vor Feuchtigkeit geschützt aufbewahrt werden. Die Reagenzien und die bei niedriger Temperatur gelagerten Proben sollten vor der Verwendung auf Raumtemperatur gebracht werden.
4. Bitte beachten Sie die allgemeinen Richtlinien zur Biosicherheit in mikrobiologischen und biomedizinischen Laboratorien.
5. Die Abfälle einschließlich der verwendeten Reagenzien und alle Proben sind potentiell infektiös, bitte entsorgen Sie sie als infektiösen medizinischen Abfall.
[Symbol]
 |
Gebrauchsanweisung beachten |
 |
Enthält ausreichend für <n> Tests |
 |
In-vitro-Diagnostik-Medizinprodukt |
 |
Vorsicht |
 |
Verfallsdatum |
 |
Nicht wiederverwenden |
 |
Temperaturbegrenzung |
 |
Chargennummer |
 |
Katalognummer |
 |
Von Sonnenlicht fernhalten |
 |
Trocken halten |
 |
EU-Bevollmächtigter |
 |
Hersteller |
 |
Datum der Herstellung | ||
 |
Neo-nostics (Suzhou) Bioengineering Co., Ltd. Adresse: 2F, #3 Gebäude, #52 yin gang Str., TaiCang, SuZhou Stadt, Jiang Su, 215434, China Tel: 086-0512-33022690, 086-0512-33022691 E-Mail: joey.zhou@neo-nostics.com |
|
 |
Osmunda Medical Tchnology Service GmbH Adresse: Von Oppen-Weg 15, 14476 Potsdam, Germany DIMDI code: DE/0000047267 |
|


